Demencia y dolor
«Dementia and pain»
J. Alaba1, E. Arriola2, A. Navarro3, M. F. González3, C. Buiza3, C. Hernández4 y A. Zulaica4
1. Fundación Matía. Gerozerlan.
2. Unidad de Memoria y Alzheimer. Fundación Matía.
3. Fundación Instituto Gerontológico Matía. INGEMA.
4. Grupo Demencia. Fundación Matía. San Sebastián, Gipuzkoa
RESUMEN
El interés de los investigadores por el dolor, su evaluación e intervención en personas con demencia es creciente. Dada la tendencia demográfica a un incremento del envejecimiento poblacional, aumentando las patologías que presentan dolor y el avance en los conocimientos en el campo de las demencias, se identifican cambios que se producen en diferentes áreas cerebrales implicadas en el control del dolor. La presente revisión se centra en las modificaciones que se producen en la percepción del dolor en las personas con demencia, así como analizar los instrumentos más eficaces para reconocer, valorar y tratar el dolor en las personas con demencia. El abordaje integral del dolor debe tener en cuenta a los cuidadores, para prevenir la sobrecarga de los mismos y garantizar la máxima calidad de vida posible de los pacientes.
Palabras clave: Dolor. Demencia. Anciano.
ABSTRACT
The interest of researchers for the pain assessment and intervention in people with dementia is growing. Given the demographic trend to an increased aging population, increasing with pain conditions and progress in knowledge in the field of dementia, identify changes that occur in different brain areas involved in pain control. This review focuses on the changes that occur in the perception of pain in people with dementia as well as analyzing the most effective tools to identify, assess and treat pain in people with dementia. The comprehensive approach of pain should take into account carers, to prevent overload them and ensure the highest possible quality of life of patients.
Key words: Pain. Dementia. Elderly.
Introducción
El envejecimiento produce un aumento de patologías potencialmente causantes de dolor nociceptivo, como enfermedades degenerativas o inflamatorias articulares, fracturas vertebrales y no vertebrales secundarias a osteoporosis senil, neoplasias, así como aumento de causas de dolor neuropático como diabetes mellitus, herpes zoster u otras neuropatías periféricas (1).
La edad constituye un factor de riesgo de presencia tanto de dolor como de demencia, y la presencia de esta influye en gran medida en la expresión del dolor, dificultando su detección. Los cambios morfológicos y funcionales que se producen en el organismo que envejece son múltiples, así como los cambios neuropatológicos de los diferentes síndromes demenciales que van a modificar los mecanismos de procesamiento y regulación del dolor (2).
A la hora de estudiar el fenómeno del dolor en pacientes con demencia, deben diferenciarse los distintos tipos de dolor (nociceptivo, neuropático, mixto), así como su temporalidad (agudo, subagudo, crónico, persistente) y la etiología de la demencia (la diferente naturaleza y localización de las lesiones afecta al procesamiento del síntoma dolor). Además, el dolor tiene componentes cognitivos, afectivos, autonómicos, y conductuales, debiendo conocerse el nivel de discapacidad que genera.
La prevalencia de dolor nociceptivo en personas mayores es del 25-50% (3) en la comunidad, incrementándose a un 49-83% en centros gerontológicos (4). En un estudio realizado a nivel nacional en centros gerontológicos se aprecia una prevalencia de dolor del 61% en residentes sin demencia (siendo el dolor en un 29% de intensidad grave y en un 64% de frecuencia diaria) y del 22% de residentes con demencia (5). En estudios realizados en Francia y Gran Bretaña, se han encontrado tasas de dolor neuropático del 7-8%, que se multiplican ocho veces en mayores de 50 años frente a personas más jóvenes (5).
La infradetección e infratratamiento del dolor se da frecuentemente en personas mayores, al ser considerado por parte de profesionales sanitarios y familiares, como un síntoma asociado al propio proceso de envejecimiento, o bien por miedo de los propios pacientes a los riesgos del tratamiento o de las pruebas diagnósticas, influyendo en gran medida las experiencias previas y el entorno social así como la propia capacidad de expresión y comunicación (6).
Se conoce que los pacientes neoplásicos mayores de 75 años reciben menos analgesia que los jóvenes, y en ellos, además, la presencia de deterioro cognitivo supone un predictor independiente de infradetección (7). La incidencia del dolor aumenta en el último año de vida y es más frecuente en los pacientes geriátricos. Esta discriminación se intensifica en los pacientes con demencia. Así, pacientes en convalecencia de fractura de cadera que presentan demencia reciben un tercio de dosis de morfina que las personas sin demencia ante la misma lesión, y en un 76% de estos casos no hay órdenes de intervención tras dolor incidental (8). Los pacientes con demencia reciben analgesia adecuada en un 33%, frente a un 64% de los pacientes sin demencia (9). Asimismo se observa que el uso de analgesia es menor en pacientes con diagnóstico de enfermedad de Alzheimer frente a los que presentan demencia vascular (10).
En otras patologías neurodegenerativas como la enfermedad de Parkinson, aproximadamente un 40% de los diagnosticados presenta dolor crónico secundario a trastornos del movimiento. Por otro lado, los propios tratamientos como la levodopa pueden causar dolor o parestesias (11).
El dolor crónico es la causa más frecuente de sufrimiento y discapacidad, afectando en gran manera a la calidad de vida del sujeto. Un inadecuado control del mismo produce alteraciones fisiológicas, tendencia a la depresión, empeoramiento cognitivo, trastornos del sueño, deterioro funcional, aislamiento e incremento de los costes sanitarios (12).
En las personas con demencia el dolor se puede manifestar como agitación, confusión, trastornos de movilidad, aumentando la carga de sufrimiento a los cuidadores. Los cuidadores formales a menudo infraestiman la presencia de dolor (13) y los cuidadores informales (familia) tienden a sobreestimarlo (14). Estudios recientes sugieren que enfermeras, cuidadores, familiares y auxiliares puedan reconocer la presencia pero no la intensidad de dolor en pacientes cognitivamente deteriorados (15). Todo ello conlleva un empeoramiento sustancial de la calidad de vida en personas con gran vulnerabilidad y corta expectativa de vida, por lo que supone una obligación deontológica su adecuado manejo.
Fisiopatología del dolor
El procesamiento del dolor a través de los receptores nociceptivos es transmitido por dos vías principales: en primer lugar el componente lateral del dolor, formado por el sistema neoespinotalámico que finaliza en el tálamo contralateral y envía fibras a la formación reticular, utilizando como principal neurotransmisor el glutamato, se encarga de la transmisión de la sensibilidad del tacto protopático, dolor agudo y temperatura, es decir, del componente sensorial discriminativo que se encarga de la localización e intensidad del dolor; la segunda vía, el componente medial del dolor, formado por el sistema paleoespinotalámico, que alcanza la formación reticular troncoencefálica y la sustancia gris periacueductal finalizando en hipotálamo y tálamo, transmitiendo el dolor sordo con fuerte componente emocional.
Las aferencias sensitivas del tálamo llegan a la corteza cerebral, implicando muchas áreas corticales y varios núcleos talámicos. Estas zonas cerebrales, junto a los factores moduladores y reguladores del dolor, hacen que el procesamiento y la percepción del dolor sea un fenómeno de gran complejidad y que cualquier alteración en diferentes partes del sistema pueda alterar el mismo. La corteza S1 localiza el lugar del estímulo doloroso. Las cortezas S1, SII, corteza insular posterior y cingular anterior caudal están implicadas en el componente sensorial del dolor, mientras que la corteza cingular anterior rostral y orbitofrontal lo están en el componente afectivo (16).
Envejecimiento
Es difícil establecer el umbral entre lo normal y lo patológico en los cambios cognitivos debidos al propio envejecimiento, ya que pueden darse tanto alteraciones del funcionamiento neuropsicológico (17) como alteraciones macroscópicas (atrofia cerebral, placas y ovillos neurofibrilares) sin presencia de demencia (18), lo que demuestra la gran variabilidad en la expresividad clínica y la alta heterogeneidad en función de las comorbilidades, fármacos y reserva funcional adquirida.
Por otra parte, en el proceso de envejecimiento se van a producir alteraciones en los sistemas nervioso central y periférico relacionados con el procesamiento del dolor, y en los sistemas de control endógeno inhibitorio, disminuyendo el umbral del dolor. Hay además una disminución de neurotransmisores monoaminérgicos (noradrenalina, dopamina, serotonina) y de receptores opiáceos en diencéfalo, protuberancia, médula y sustancia gris periacueductal (19). En pruebas de neuroimagen se aprecia una disminución de la activación frente al dolor del caudado contralateral y putamen en RMN (20).
En el estudio de pacientes con dolor crónico se aprecian modificaciones cerebrales con cambios difusos en el giro cingulado, giro postcentral, giro frontal superior, siendo la microarquitectura cerebral más compleja y activa que en controles, lo que influye en el procesamiento del dolor, modificaciones de la respuesta emocional y de la adaptación al estrés.
Muchos de estos cambios hallados en pruebas de neuroimagen funcional demuestran la gran variabilidad existente, así como cambios dinámicos que pueden producirse en relación a la técnica o heterogeneidad de sujetos a estudio, sin una clara implicación clínica.
Demencias
En los pacientes con demencia no se aprecian cambios en el umbral de respuesta al dolor, pero sí en la tolerancia al mismo. Por lo tanto, el componente sensorial está indemne, mientras que el componente afectivo del dolor se encuentra modificado. El síndrome demencial más frecuente es la enfermedad de Alzheimer (EA), en la que se produce un acúmulo de beta amiloide y proteína tau hiperfosforilada en la corteza entorrinal, amígdala e hipocampo, alterando en gran medida estas estaciones moduladoras y reguladoras del dolor. La neurodegeneración afecta también a estructuras cerebrales implicadas en el control inhibitorio del dolor, como el núcleo del rafe, el sistema nervioso vegetativo y en el núcleo talámico intralaminar (21).
En diferentes estudios se aprecia una disminución de la incidencia, gravedad y duración de la cefalea postpunción tras una punción lumbar como ejemplo de dolor agudo en pacientes con EA. La frecuencia de dolor tras movimiento también es menor, sin apreciarse trastornos conductuales (22).
La respuesta autonómica o vegetativa al dolor decrece en pacientes con EA con estímulos umbral, normalizándose la respuesta sólo con estímulos más intensos. Esto nos explica la poca importancia que tiene esta sintomatología en la medida final del dolor ya que esta se manifiesta solo con estímulos dolorosos importantes. Este embotamiento del sistema es debido a la localización de las lesiones en la EA (23).
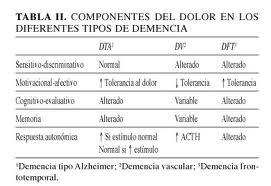
Revisando los diferentes componentes del dolor en relación al tipo de demencia, se pueden apreciar las diferencias de forma didáctica, aunque en la realidad es probable que confluyan de forma heterogénea por la alta variabilidad individual.
En la demencia vascular tienen incrementado el componente emocional del dolor, ya que las lesiones de sustancia blanca incrementan la sensibilidad por desaferenciación, estando relacionado con la presencia de dolor central (24).
En la demencia frontotemporal se aprecia una reducción del procesamiento y del componente emocional, presentando una mayor tolerancia al mismo (25).
En la demencia de cuerpos de Lewy se produce una reducción de la percepción del dolor y del sufrimiento, siendo las lesiones de sustancia blanca similares a las de la EA, sin embargo la alteración fundamental se da en el área parasilviana (26).
La corteza prefrontal controla el procesamiento del dolor y la respuesta analgésica en el dolor crónico (27). Antiguamente, ante dolores muy refractarios como neuralgias del trigémino, se practicaba una lobotomía frontal bilateral. Según la etiología de la demencia se han definido cambios en la neuroanatomía y la expresión de diferentes componentes del dolor, que se especifican en las tablas I y II, así como los cambios de la percepción del dolor en pacientes con EA (Tabla III).

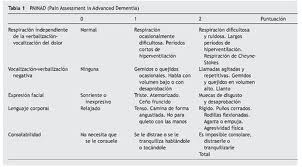
Valoración del dolor
La medición del dolor mediante escalas o autoinformes en pacientes cognitivamente sanos no varía en relación con los pacientes más jóvenes. Los parámetros que se evalúan son similares incluyendo aquellos factores que agravan o alivian el dolor, impacto del dolor e historia social de la persona.
Evaluar el dolor en las personas mayores con demencia, especialmente en etapas avanzadas, es un reto. Aunque existe percepción de dolor en el deterioro cognitivo, muchas veces no es detectado porque muchas de estas personas han perdido las habilidades verbales para expresarlo y/o porque en ocasiones la naturaleza de su trastorno puede estar impidiendo que lo identifiquen. Asimismo, para los cuidadores y profesionales la identificación del dolor en personas con demencia resulta bastante compleja debido, entre otras cosas, a la insuficiente formación o entrenamiento para identificarlo (29).
En algunas ocasiones, la expresión de dolor se presenta como cambios sutiles de comportamiento que pueden dificultar el proceso de recogida de datos. Por este motivo, la Sociedad Americana de Geriatría (AGS) ha recogido en una guía indicadores conductuales de dolor en personas mayores con demencia que faciliten la valoración y el manejo (30). En ellas aparecen identificados seis tipos de conducta de dolor con ejemplos específicos de comportamientos observables (5).
La medición del dolor en el deterioro cognitivo depende del estadiaje de enfermedad. De tal forma que, únicamente en estadios iniciales de demencia se pueden utilizar con seguridad escalas visuales analógicas puesto que, en estadios más avanzados, la pérdida de razonamiento abstracto provoca que los conceptos manejados en las escalas puedan no ser comprendidos, aún siendo escalas muy simples (31).
Los instrumentos de medida se pueden clasificar en autoinformes (preguntando a la propia persona sobre el dolor), medidas fisiológicas (presión sanguínea, pulsaciones, etc.) que no son específicas de dolor y observación comportamental (observación directa del comportamiento de la persona).
Los autoinformes proporcionan suficiente información sobre el dolor en las personas cognitivamente intactas y permite a los profesionales manejar el dolor de una manera eficaz (32). Son considerados como la medida más fiable y afinada de la existencia e intensidad del dolor. Sin embargo, cuando la persona tiene reducida la capacidad para recordar, entender y responder a cuestiones sobre su experiencia de dolor, su utilización resulta más complicada. El componente del dolor que se mide frecuentemente a través de autoinformes es la intensidad del dolor. Los autoinformes más utilizados son las escalas categóricas del dolor (Verbal Rating Scale-VRS-) y las escalas visuales analógicas (Numeric Pain Rating Scale -NRS-). Menos común es el uso de las escalas pictóricas (Faces Pain Scale -FPS-).
La escala pictórica de dolor es una de las preferidas por un alto porcentaje de personas mayores. Además, cuenta con buenas propiedades psicométricas en personas mayores españolas con bajo nivel cultural puesto que sólo deben elegir entre diferentes caras con expresiones diferentes, eliminando así el componente verbal.
La medida de los estados fisiológicos que acompañan a las experiencias de dolor son posibles indicadores de dolor cuando la persona no puede expresarlo. Entre las medidas fisiológicas que se están utilizando como indicadores de dolor se incluyen la frecuencia respiratoria, presión arterial, sudoración palmar, la liberación de hormonas del estrés (corticoides, catecolaminas, glucagón y hormona del crecimiento), la liberación de cortisol y las concentraciones de endorfinas (33).
Muchos de estos indicadores fisiológicos proporcionan información importante, pero no deben utilizarse de manera aislada debido a su falta de especificidad. Alteraciones en la mayoría de los parámetros fisiológicos y hormonales no son exclusivos de dolor, sino que reflejan una respuesta global al estrés relacionado con el dolor, o bien una respuesta a estrés fisiológico como la causada por el proceso de la enfermedad misma o a la comorbilidad acompañante. Además, la medición de estos indicadores es invasiva, lenta y costosa.
Como alternativa viable a la evaluación verbal y a las medidas fisiológicas, se han desarrollado varias medidas de observación comportamental para medir el dolor y los conceptos relacionados, tales como molestia, disconfort, etc., pero dichas medidas varían mucho en su fiabilidad, validez y aplicabilidad.
Dentro de las escalas observacionales podemos incluir la Escala de evaluación del dolor en ancianos con demencia -EDAD- (34), la escala Pain Assessment for Dementia in the Elderly -PADE- (35), la escala Rating Pain in Dementia -RAPID- (36), la escala Pain Assessment Checklist for Seniors with Limited Ability to Communicate-PACSLAC- (37), la Abbey Pain Scale (38), el Checklist of Nonverbal Pain Indicators -CNPI- (39), la escaladiscomfort in dementia of the Alzheimer’s type -DS-DAT- (40), el Noncommunicative Patient’s Pain Assessment Instrument -NOPPAIN- (41), la Doloplus-2 (42) y la Pain Assessment in Advanced Dementia Scale -PAINAD- (43), en proceso de validación en nuestro entorno (Tabla IV).
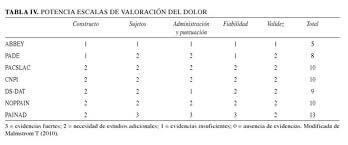
La Escala de evaluación del dolor en ancianos con demencia -EDAD- (34) evalúa el dolor de la persona en tres momentos diferentes: antes de aplicar cuidados potencialmente dolorosos, durante la aplicación de los cuidados y observación del comportamiento en las últimas 48 horas. Cada uno de los ítems se puntúa de 0 a 2. Se considera que existe dolor si la puntuación total es igual o superior a 3.
La escala Pain Assessment for Dementia Elderly -PADE- (35) está formada por 3 partes con 24 ítems en total: valoración física (expresión facial, respiración y postura), global (intensidad del dolor) y funcional (actividades de la vida diaria). Aunque incluye la mayor parte de los indicadores propuestos por la AGS, su operatividad no está clara.
La escala Rating Pain in Dementia -RAPID- (36) está formada por 18 ítems que cubren el área emocional, comportamental, autonómica y postural. Los ítems se puntúan en una escala que va de 0 (ausente) a 3 (grave). La puntuación total de la escala va de 0 a 54 puntos.
La escala Pain Assessment Checklist for Seniors with Limited Ability to Comunicate -PACSLAC- (37) está formada por 60 ítems agrupados en 4 categorías: expresión facial, movimientos del cuerpo, indicadores fisiológicos e indicadores psicosociales. Cada uno de los ítems se puntúa en una escala dicotómica (presencia o ausencia). Es considerada un instrumento muy útil y comprensible puesto que engloba todos los criterios conductuales propuestos en la guía de la AGS. Sin embargo, son necesarios estudios de validez y fiabilidad.
La Abbey Pain Scale (38) es una herramienta australiana desarrollada para medir la intensidad del dolor en personas con demencia en estadios avanzados. Está formada por 6 ítems: vocalización, expresión facial, cambios en el lenguaje corporal, cambios conductuales, cambios fisiológicos y cambios físicos. Cada uno se evalúa en una escala de intensidad de 4 puntos (de 0 ausencia de dolor a 3 dolor severo). Esta escala se encuentra en vías de validación en el Hospital San Carlos de Madrid.
El Checklist of Nonverbal Pain Indicators -CNPI- (39) incluye seis ítems conductuales de dolor comúnmente observados en personas mayores incluyendo vocalizaciones no verbales, muecas, inquietud, frotarse, quejas verbales y tensión. Cada uno es puntuado en una escala dicotómica siendo 1 presencia de dolor y 0 no presencia tanto cuando la persona está en descanso como en movimiento. Muestra buena fiabilidad y acuerdo interjueces.
La escala discomfort in dementia of the Alzheimer’s type -DS-DAT- (40) fue diseñada para evaluar el malestar de las personas con demencia avanzada que han perdido su capacidad cognitiva y de comunicación verbal. Incluye 9 ítems: respiración ruidosa, vocalizaciones negativos, la expresión facial de contento/expresión de la cara triste, asustado, fruncir el ceño, lenguaje corporal relajado, lenguaje corporal tensa, e inquietud. Cada ítem se mide por la ausencia o presencia de malestar. Si está presente, se califica su frecuencia, duración e intensidad. Su método de administración y puntuación es complejo, requiere formación pero sin embargo es la más recomendada para trabajos de investigación.
El Noncommunicative Patient’s Pain Assessment Instrument -NOPPAIN- (41) se centra en la observación de comportamientos específicos de dolor durante las tareas diarias de atención (baño, traslados, vestirse, etc.). Puede ser administrado por las auxiliares de enfermería para la evaluación de conductas de dolor en pacientes con demencia. El dolor se evalúa en reposo y en movimiento. Cuenta con la limitación de que sus procedimientos de puntuación no están claros.
El Dolopus 2 (42) es considerada una herramienta comprensible y reúne la mayor parte de los criterios de la AGS. Está formada por 10 ítems agrupados en 3 subescalas: reacciones somáticas, reacciones psicomotoras y reacciones psicosociales. Del mismo modo que la escala PAINAD, asume que los cuidadores o profesionales pueden indicar de modo confiable el nivel de intensidad del dolor de las personas mayores con demencia, hecho que no está apoyado por la literatura científica. Cuenta con una versión reducida denominada Doloshort que incluye 5 ítems asociados significativamente con la escala analógica visual en un modelo de regresión múltiple. Actualmente, está en proceso de validación en cinco idiomas diferentes.
La Pain Assessment in Advanced Dementia Scale -PAINAD- (43) fue diseñada con el fin de proporcionar una herramienta de valoración sencilla y relevante clínicamente para personas con demencia en estadios avanzados. Incluye 5 ítems: respiración, vocalizaciones, expresión facial, lenguaje corporal y consolabilidad. Cubre tres de los seis criterios de conductas de dolor recogidas por la AGS.
De todas las pruebas mencionadas, las que presentan mejores propiedades psicométricas en cuanto a validez, fiabilidad y homogeneidad en personas con demencia son la DOLOPLUS-2 (más utilizada por enfermería), el PACSLAC y la PAINAD. La escala PAINAD presenta una correcta validez de constructo y una buena fiabilidad interjueces, mientras que la escala PACSLAC tiene una mayor validez de contenido, siendo la muestra estudiada superior, aunque la fiabilidad inter- e intraevaluador es menor (44).
Por otra parte, algunos autores concluyen que en vista de la complejidad de puntuación e interpretación de la DS-DAT, y el gran número de elementos de la PACSLAC, el PAINAD parece la mejor escala posible para la práctica clínica (45,46) (Tabla IV). En dicha tabla aparece la valoración de algunas escalas observacionales del dolor. Se han evaluado en función de 5 criterios: a) constructo que se refiere a si la escala cuenta con una adecuada claridad conceptual; b) sujetos si se han utilizado muestras de sujetos representativas; c)administración y puntuación si el procedimiento de aplicación e interpretación de las puntuaciones está claro; d)fiabilidad o consistencia interna de la escala; y e) validez o capacidad de la escala para medir lo que realmente quiere medir.
A pesar de que el desarrollo de estos instrumentos ha supuesto un avance, ninguno de ellos ha demostrado tener suficiente utilidad práctica como herramienta que informe a otros profesionales sobre el manejo adecuado del dolor por lo que es necesario seguir investigando en este ámbito. La utilidad más importante de las evaluaciones de dolor en la demencia es su capacidad para alertar a los cuidadores sobre los beneficios del tratamiento del dolor para el bienestar de la persona. Es decir, los instrumentos de evaluación deben mostrar la capacidad suficiente para identificar a aquellas personas cuyas manifestaciones de dolor disminuirán después de recibir tratamiento para el dolor.
Tratamiento
El manejo farmacológico del dolor en el paciente anciano es complicado por el aumento en las reacciones adversas que se producen en general, y con los opiáceos y coadyuvantes en particular, que dificultan en gran manera un adecuado control del dolor junto a un mantenimiento de la situación funcional. Estas consideraciones son aún mayores en las personas con demencia, en relación a su vulnerabilidad neurológica, aumentando en ellos la sedación y los efectos secundarios periféricos de los opiáceos, como estreñimiento y retención urinaria. Los fármacos que están más implicados en el desarrollo de reacciones adversas son los psicofármacos, y la forma de aparición más frecuente es a través de síntomas neuropsiquiátricos (47), aumentando de esta manera el riesgo de caídas, confusión u hospitalización. La edad avanzada, presencia de demencia, múltiples prescriptores y la polifarmacia son factores de riesgo de las mismas.
El componente «expectativa» del placebo desaparece con la afectación de las áreas frontales (funciones ejecutivas) en pacientes con enfermedad de Alzheimer y especialmente en pacientes con demencias que afecten al lóbulo frontal. Causa de que no sea ético el uso de placebos para el control del dolor en estos pacientes (25).
Con el envejecimiento se producen cambios farmacocinéticos al retrasarse la tasa de absorción gástrica, disminuir el agua corporal y aumento de la grasa corporal modificando los volúmenes de distribución de los fármacos hidro- y liposolubles, cambios en procesos de fase I del metabolismo hepático e hipoalbuminemia y disminución de filtrado glomerular; así como cambios farmacodinámicos por modificaciones de los receptores incrementando la sensibilidad a diferentes fármacos (4).
Existen diferentes guías de manejo del dolor en personas ancianas, así la American Geriatric Society en el 2009 actualizó la guía del 2002 (48) y un consenso de expertos sobre el manejo de los opiáceos en diferentes tipos de dolor (49), recomendando evitar AINE, para evitar los riesgos gastrointestinales y cardiovasculares, así como el uso de opiáceos en dolor moderado.
Los ensayos clínicos en personas mayores son escasos ya que frecuentemente son excluidos de los mismos, especialmente por la presencia de comorbilidad y la polifarmacia provocando la disminución de la validez externa de los mismos. Todo ello dificulta la toma de decisiones al no conocerse adecuadamente la relación riesgo/beneficio que conlleva la intervención farmacológica.
Como analgésicos de primer escalón el uso de paracetamol es de elección no superando dosis de 4 gramos al día, estando contraindicado en pacientes con insuficiencia hepática. Para un adecuado uso de AINE o inhibidores de COX2, debe valorarse la toxicidad gastrointestinal y renal, la presencia de comorbilidades como hipertensión o insuficiencia cardiaca, así como las posibles interacciones fármaco-fármaco y fármaco-enfermedad. La FDA en junio 2009 realizó una alerta de seguridad ante la venta de múltiples fármacos que contienen paracetamol en su molécula, a tener en cuenta para no sobrepasar dosis máximas del mismo.
En cuanto al manejo de opiáceos en el anciano, con el tramadol debe tenerse especial cuidado en los pacientes en tratamiento con inhibidores selectivos de recaptación de monoaminas (noradrenalina y serotonina) como venlafaxina, duloxetina y los ISRS más selectivos, por el riesgo de aparición de un síndrome serotoninérgico. La morfina y la hidromorfona son de eliminación renal por lo que debe ajustarse en relación a la función renal, sin embargo la oxicodona y la buprenorfina no requieren dichos ajustes por lo que las hacen más seguras en el paciente anciano. El fentanilo no debe usarse si el peso corporal es inferior a 50 kg, y debe tenerse en cuenta que el calor y el aumento de temperatura aumenta su absorción, incrementándose el riesgo de reacciones adversas. La meperidina presenta propiedades neuroexcitatorias, disminuyendo el umbral convulsivo. En las tablas V y VI se muestra la evidencia en cuanto al uso de opiáceos en ancianos y las dosis recomendadas, que contrastan frecuentemente con la práctica asistencial.
Los efectos secundarios se producen de forma rápida, y muchas veces pueden prevenirse por lo que se debe instaurar tratamientos profilácticos. En caso de alergia debe conocerse la composición química para realizar modificaciones terapéuticas:
- Fenantrenos: morfina, hidromorfona, oxicodona, codeína.
- Fenilpiperidinas: fentanilo, meperidina.
Como normas a tener en cuenta a la hora de prescribir opioides, se debe comenzar con dosis bajas y aumentar lentamente (Start low and go slow), utilizar preparados de liberación inmediata con opioides de vida media corta, indicarlos en horarios fijos e indicar rescates. Debe titularse la dosis en función del efecto esperado (que es la disminución del dolor), buscando alcanzar un equilibrio entre el control del dolor y el riesgo de efectos secundarios que pueden alterar la funcionalidad, individualizando la dosis. No debe olvidarse una adecuada hidratación del paciente y una valoración nutricional pues estos dos parámetros influyen en gran manera en el metabolismo de los diferentes opiáceos.
En las personas con dificultades de comunicación se debe prestar especial atención a cualquier modificación del estado basal para reconocer prontamente posibles reacciones adversas. Si se van a utilizar psicofármacos para el manejo de síntomas psicológicos y conductuales de la demencia debe disminuirse la dosis de opiáceos un 25 a 50% para prevenir reacciones adversas neuropsicológicas (1). La aparición de depresión respiratoria es poco frecuente aunque debe prestarse especial precaución en aquellos pacientes con broncopatía previa o toma de psicofármacos que potencialmente causen hipoventilación.
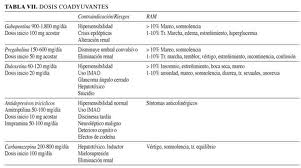
La utilización de fármacos coadyuvantes, anticomiciales, antidepresivos u otros psicofármacos, debe ser cuidadosa e individualizada, para garantizar la máxima seguridad. En la tabla VII se muestran las dosis recomendadas y las reacciones adversas más frecuentes de los diferentes coadyuvantes.
Una valoración adecuada junto a la implementación de medidas no farmacológicas, como la cinesiterapia y la termoterapia, potenciando la movilidad que evite inmovilismo inducido, va a ser crucial en el manejo del dolor en el paciente demente. Para alcanzar dichos objetivos es esencial una adecuada formación de los cuidadores tanto familiares como profesionales.
Desde un punto de vista práctico ante cualquier conducta sospechosa de ser causada por el dolor, debe valorarse si se incrementa o no con el movimiento considerando las medicaciones previas, intentando modificar el dolor provocado por el movimiento y tranquilizar el temor relacionado con la conducta. Si la conducta sospechosa no se relaciona con el movimiento debe garantizarse que las necesidades básicas de confort están resueltas (higiene, hambre, sed, calor, frío) e iniciar la búsqueda activa de posibles factores desencadenantes (estreñimiento, infección respiratoria o urinaria, malnutrición). En aquellos casos que no se encuentre ningún factor precipitante se puede intentar un tratamiento analgésico empírico para modificar la conducta. En todos los casos se debe monitorizar y valorar la respuesta al tratamiento (Fig. 1).
Conclusiones
- Existe una infradetección e infratratamiento del dolor en los pacientes dementes con graves repercusiones funcionales y sobre la calidad de vida.
- Se recomienda en la valoración del dolor utilizar escalas adaptadas y validadas, puesto que no todos los instrumentos de evaluación del dolor son apropiados para todas las personas o para todas las situaciones o tipos de dolor.
- El dolor puede manifestarse como delirium o trastornos afectivos, siendo frecuente la presentación atípica. En las personas con demencia los equivalentes de dolor como cambios conductuales, deben aumentar la atención de los profesionales sanitarios y generar una actitud proactiva al tratamiento.
- Cognitivamente pueden proporcionar información acerca de la presencia o ausencia de dolor, pero pueden tener dificultad para proporcionar información precisa sobre las características del dolor tales como la ubicación, frecuencia, duración, inicio, temporalidad, variación y síntomas que la acompañan.
- La investigación futura sobre los instrumentos de valoración de dolor deben abordar la determinación de cuáles son los instrumentos fiables y válidos en los diferentes niveles cognitivos de deterioro.
- La prescripción farmacológica debe ir precedida de una información adecuada y el establecimiento de un plan terapéutico compartido con los familiares.
- Realizar una monitorización y seguimiento adecuado de las intervenciones, así como valoraciones funcionales, cognitivas y conductuales de forma periódica.
Bibliografía
1. Herr K, Bjoro K, Decker D. Tools for assessment of pain in nonverbal older adults with dementia: a state of the science review. J Pain Symptom Manage 2006;31(2):170-92.
2. Fine P. Chronic pain management in older adults: special considerations. J Pain Symptom Manage 2009;38(2Supl.): S4-S14.
3. Scherder E, Herr K, Pickering G, Gibson S, Benedetti F, Lautenbacher S. Pain in dementia. Pain 2009; 145(3):276-8.
4. Kunz M, Mylius V, Scharmann S. Influence of dementia in on multiple components of pain. Eur J Pain 2009;13:317-25.
5. Alaba J, Arriola E. Prevalencia de dolor en pacientes geriátricos institucionalizados. Rev Soc Esp Dolor 2009;16:344-52.
6. Ferrell BA, Ferrell BR, Rivera L. Pain in cognitively impaired nursing home patients. J Pain Symptom Manage 1995;10:591-8.
7. Bennett MI, Bouhassira D. Epidemiology of neuropathic pain: can we use the screening tools? Pain 2007;132:12-3.
8. Engle VF, Graney MJ, Chan A. Accuracy and bias of licensed practical nurse and nursing assistant ratings of nursing home residentsí pain [see comment]. J Gerontol A Biol Sci Med Sci 2001;56:M405-11.
9. Zyczkowska J, Szczerbinska K, Jantzi MR, Hirdes JP. Pain among the oldest old in community and institutional settings. Pain 2009;129:167-76.
10. Bernabei R, Gambassi G, Lapane K, Landi F, Gatsoni C, Dunlop R, et al. Management of pain in elderly patients with cancer. JAMA 1998;279:1877-82.
11. Morrison RS, Siu AL. A comparison of pain and its treatment in advanced dementia and cognitively intact patients with hip fracture. J Pain Symptom Manage 2000;19:240-8.
12. Brummel-Smith K, London MR, Drew N, Krulewitch H, Singer C, Hanson L. Outcomes of pain in frail older adults with dementia. J Am Geriatr Soc 2002;50: 1847-51.
13. Schuler M, Njoo N, Hestermann M, Oster P, Hauer K. Acute and chronic pain in geriatrics: clinical characteristics of pain and the influence of cognition. Pain Med 2004;5:253-62.
14. Ferrell BA, Ferrell BR, Osterweil D. Pain in the nursing home. J Am Geriatr Soc 1990;38:409-14.
15. Roy R, Thomas MR. A survey of chronic pain in an elderly population. Can Fam Physician 1986;32:513-6.
16. Reinoso-Suarez F. Neurobiología del dolor. Algia 2007;11:25-39.
17. Cook IA, Leuchter AF, Morgan ML, Conlee EW, David S, Lufkin R, et al. Cognitive and physiologic correlates of subclinical structural brain disease in elderly healthy control subjects. Arch Neurol 2002;59:1612-20.
18. Knopman DS, Parisi JE, Salviati A, Floriach-Robert M, Boeve BF, Ivnik RJ, et al. Neuropathology of cognitively normal elderly. J Neuropathol Exp Neurol 2003;62:1087-95.
19. Karp JF, Sega JW, Weiner K. Advances in understanding the mechanisms and management of persistent pain in older adults. Br J Anaesth 2008;101(1):11-20.
20. Cole LJ, Farrell MJ, Gibson SJ, Egan GF. Age-related differences in pain sensitivity and regional brain activity evoked by noxious pressure. Neurobiol Aging 2010;31(3):494-503.
21. Mantyselka P, Hartikainen S, Louhivuori-Laako K, Sulkava R. Effects of dementia on perceived daily pain in home-dwelling elderly people: a population-based study. Age Ageing 2004;33(5):496-9.
22. Horgas A, Elliot A, Marsiske M. Pain assessment in persons with dementia: relationship between self-report and behavioral observation. J Am Geriatr Soc 2009;57:126-32.
23. Benedetti F, Arduino C, Vighetti S, Asteggiano G, Tarenzi L, Rainero I. Pain reactivity in Alzheimer patients with different degrees of cognitive impairment and brain electrical activity deterioration. Pain 2004;111:22-9.
24. Mori E. Impact of subcortical ischemic lesions on behavior and cognition. Ann NY Acad Sci 2002;977:141-8.
25. Bathgate D, Snowden JS, Varma A, Blackshaw A, Neary D. Behaviour in frontotemporal dementia, Alzheimerís disease and vascular dementia. Acta Neurol Scand 2001;103:367-78.
26. Burton EJ, Karas G, Paling SM, Barber R, Williams ED, Ballard CG, et al. Patterns of cerebral atrophy in dementia with Lewy bodies using voxel-based morphometry. Neuroimage 2002;17:618-30.
27. Scherder E, Bouma A. Acute versus chronic pain experience in Alzheimerís disease. Dement Geriatr Cogn Disord 2000;11:11-6.
28. Scherder EJA, Sergeant JA, Swaab DF. Pain processing in dementia and its relation to neuropathology. Lancet Neurol 2003;2:677-86.
29. McAuliffe L, O’Donnell M, Nay R. Successful pain assessment in older adults with dementia: barriers and strategies (review). Royal College of Nursing Australia Monograph. Australian Centre for Evidence Based Aged Care; 2008.
30. American Geriatrics Society. The management of persistent pain in older persons. AGS Panel on Persistent Pain in Older Persons. J Am Ger Soc 2002;50:205-24.
31. Weiner DK. Pain in nursing home residents: what does it really mean, and how can we help? J Am Geriatr Soc 2004;52:1020-2.
32. Herr KA, Garand L. Assessment and measures of pain in older adults. Clin in Geriatr Med 2001;17:457-78.
33. Gagliese L. Assessment of pain in elderly people. In: Turk DC, Melzack R, editors. Handbook of Pain Assessment. New York-London: The Guilford Press; 2001. p. 119-33.
34. Baeza R, Baños JE, Torubia R. Escala de evaluación del dolor en ancianos con demencia (EDAD). Tesis Doctoral. Universidad Autónoma de Barcelona; 2006.
35. Villanueva MR, Smith TL, Erickson JS, Lee AC, Singer CM. Pain assessment for the dementing elderly (PADE): reliability and validity of a new measure. J Am Med Dir Assoc 2003;4:1-8.
36. Sign B, Orrell M. The development, validity and reliability of a new scale for rating pain in dementia (RaPID). Unpublished manuscript; 2003.
37. Fuchs-Lacelle S, Hadjistavropoulos T. Development and preliminary validation of the pain assessment checklist for seniors with limited ability to communicate (PACSLAC). Pain Manag Nurs 2004;5:37-49.
38. Abbey J, Piller N, Bellis de A, Esterman A, Parker D, Giles L, et al. The Abbey pain scale: a 1-minute numerical indicator for people with end stage dementia. Int J Palliat Nur 2004;10:6-14.
39. Feldt K. The checklist of nonverbal pain indicators (CNPI). Pain Manage Nurs 2000;1:13-21.
40. Hurley AC, Volicer BJ, Hanrahan PA, Houde S, Volicer L. Assessment of discomfort in advanced Alzheimer patients. Res Nur Health 1992;15(5):369-77.
41. Snow AL, O’Malley KJ, Cody M, Kunik ME, Ashton CM, Beck C, et al. A conceptual model of pain assessment for non-communicative persons with dementia. Gerontologist 2004;44:807-17.
42. Lefebvre-Chapiro S. The Doloplus 2 scale – evaluating pain in the elderly. Eur J Pall Care 2001;8:191-4.
43. Warden V, Hurley AC, Volicer L. Development and psychometric evaluation of the Pain Assessment in Advanced Dementia (PAINAD) scale. J Am Med Dir Assoc 2003;4(1):9-15.
44. Zwakhalen SM, Hamers JP, Abu-Saad HH, Berger MP. Pain in elderly people with severe dementia: a systematic review of behavioural pain assessment tools. BMC Geriatrics 2006;6:3.
45. Van Herk R, van Dijk M, Baar FPM, Tibboel D, de Wit R. Observation scales for pain assessment in older adults with cognitive impairments or communication difficulties. Nursing Research 2007;56:34-43.
46. Malmstrom T, Tait R. Pain assessment and management in older adults. Handbook of Assessment in Clinical Gerontology. 2nd ed. 2010. p. 647-77.
47. Gurwitz JH, Field TS, Jud J, Rochon P, Harrold LR, Cadoret C, et al. The incidence of adverse drug events in two large academic long-term care facilities. Am J Med 2005;118:251-8.
48. Ginsburg M, Silver S, Berman H. Prescribing opioids to older adults: a guide to choosing and switching among them. Geriatrics and Aging 2009;12(1): 48-52. [ Links ]
49. American Geriatrics Society Panel on the Pharmacological Management of Persistent Pain in Older Persons. Pharmacological Management of Persistent Pain in Older Persons. JAGS 2009;57:1331-46.
https://scielo.isciii.es/scielo.php?pid=S1134-80462011000300005&script=sci_arttext
Imagen superior: Google
Descubre más desde Alzheimer Universal
Suscríbete y recibe las últimas entradas en tu correo electrónico.
