Deterioro cognitivo y demencia leve
Los médicos de atención primaria son el primer punto de contacto para la mayoría de los pacientes con estos trastornos por lo que deben estar familiarizados con el diagnóstico, el pronóstico y la gestión.

Autor: David S. Knopman, MDemail, Ronald C. Petersen, PhD, MD Fuente: Mayo Clinic Proceedings Mild Cognitive Impairment and Mild Dementia: A Clinical Perspective
Desarrollo
Resumen
El deterioro cognitivo leve y la demencia leve son problemas comunes en los ancianos. Los médicos de atención primaria son el primer punto de contacto para la mayoría de los pacientes con estos trastornos por lo que deben estar familiarizados con el diagnóstico, el pronóstico y la gestión. Tanto el deterioro cognitivo leve como la demencia leve se caracterizan por la evidencia objetiva de deterioro cognitivo. La principal diferencia entre el deterioro cognitivo leve y demencia leve es que en este último, están invariablemente involucrados más de un dominio cognitivo y existe una interferencia sustancial con la vida cotidiana que es evidente.
El diagnóstico de deterioro cognitivo leve y de demencia leve se basa principalmente en la historia clínica y en el examen cognitivo.
El pronóstico para el deterioro cognitivo leve y la demencia leve es una motivación importante para el diagnóstico, porque en ambos hay un mayor riesgo de un posterior declive cognitivo.
La etiología del deterioro cognitivo leve y la demencia leve a menudo se puede establecer a través del examen clínico, aunque las imágenes y otras pruebas de laboratorio también pueden contribuir. Aunque la enfermedad de Alzheimer es la causa más común de ambos, la enfermedad cerebrovascular y la enfermedad de cuerpos de Lewy hacen contribuciones importantes.
Los tratamientos farmacológicos son de un valor moderado en la demencia leve debida a la enfermedad de Alzheimer, no hay tratamientos farmacológicos aprobados para el deterioro cognitivo leve de cualquier etiología. No obstante, el deterioro cognitivo de nueva aparición es un síntoma preocupante para los pacientes y las familias que exige respuestas y consejos. Si un paciente tiene dificultades para manejar los medicamentos, las finanzas, el transporte o vivir forma independiente, el diagnóstico y la intervención son necesarios para garantizar la salud y la seguridad del paciente.
Caso ilustrativo
[highlight color=»orange» align=»»]Un hombre de 73 años de edad, viene de su examen anual acompañado por su esposa. Después de revisar las condiciones en su lista de problemas, su esposa menciona que ella ha tenido preocupaciones acerca de sus olvidos frecuentes. El paciente se apresura a señalar que él no siente que el olvido interfiera con sus actividades. Después de preguntar si permitiría a su esposa hablar, la esposa del paciente dice: «Durante el año pasado, nuestros hijos y yo hemos notado que a menudo hace la misma pregunta una y otra vez. Él no solía hacer esto. Él no parece estar prestando atención a lo que estoy diciendo porque casi nunca se acuerda de nuestras conversaciones. Si le pido que vaya a buscar a algunas cosas a la ciudad, por lo general vuelve con las manos vacías o con sólo unas pocas de las cosas que encargué conseguir. Él no recuerda las citas. Sin embargo, no ha tenido dificultades con la conducción o con las direcciones, y sigue siendo un excelente personal de mantenimiento».[/highlight]
¿Qué debe hacer un profesional de la salud en esta situación?
Definición de deterioro cognitivo leve y demencia leve
El deterioro cognitivo en las personas mayores es una condición común, y en la mayoría de los casos, los médicos de atención primaria son el primer punto de contacto de un paciente y la familia. Entre las personas mayores de 70 años, el 14% tiene deterioro cognitivo suficiente como para justificar un diagnóstico de demencia,1 y un número igual tienen leve pero inequívoco deterioro cognitivo que puede evolucionar hacia la demencia moderada a severa2 Suelen presentarse a la atención médica ya que su necesidades de atención demandan ayuda.3 Las formas más leves de deterioro cognitivo, sin embargo, presentan desafíos conceptuales y prácticos formidables en la detección de los médicos de atención primaria.
Deterioro cognitivo leve (DCL) es el término utilizado para describir la condición de las personas cuya cognición se encuentra entre las alteraciones habituales del envejecimiento y la demencia temprana.4 (Tabla 1) Tienen evidencia objetiva de deterioro cognitivo que representa una disminución de sus habilidades con respecto al pasado, pero funcionan de forma independiente o casi en su vida cotidiana de una manera que no se distingue de la anterior.4, 5
Aunque la mayor parte de la literatura sobre DCL pertenece a las primeras manifestaciones de la enfermedad de Alzheimer, es un síndrome que podría tener muchos causas.4 La demencia leve se define también por el deterioro cognitivo y por los malos resultados en las evaluaciones cognitivas objetivas que representan una disminución respecto del pasado, pero la demencia requiere evidencia de dificultades sustanciales en la vida diaria que interfieran con su independencia.6
En la demencia leve, los pacientes mantienen independencia en las actividades más simples, en contraste con las formas más graves de demencia en la que se ven comprometidos actividades básicas de la vida diaria.
Los criterios publicados recientemente por el Manual Diagnóstico y Estadístico de los Trastornos Mentales: DSM-57 incluyen criterios para una nueva clasificación diagnóstica del trastorno neurocognitivo leve, que se parece mucho al deterioro cognitivo leve. Aunque la demencia leve representa un paso hacia el aumento clínicamente relevante del deterioro y un peor pronóstico, hay muchas similitudes en el diagnóstico y en el reconocimiento del deterioro cognitivo leve y la demencia leve. Por lo tanto, en esta revisión se explorarán las bases para el diagnóstico del deterioro cognitivo leve y de la demencia leve, y la justificación de su reconocimiento oportuno, las opciones para la gestión, y un vistazo a las tendencias futuras.

El pronóstico
Un diagnóstico de deterioro cognitivo leve o de demencia leve conlleva importantes implicaciones pronósticas. El deterioro cognitivo leve y la demencia leve representan notablemente mayor riesgo de empeoramiento durante los siguientes años.9
Por ejemplo, en el condado de Olmsted, Minnesota, la tasa de progresión a la demencia entre las personas con deterioro cognitivo leve fue del 7,1% por año, en contraste con la tasa de progresión entre las personas cognitivamente normales de 0,2% por año.9
En entornos clínicos típicos en los que deterioro cognitivo leve es probable que se diagnostique más tarde en el curso, la tasa de progresión a la demencia puede ser aún mayor. Estas tasas reflejan los promedios de todas las edades mayores de 70 años; de hecho, el riesgo de incidencia de demencia en personas con deterioro cognitivo leve aumenta con la edad, de modo que una persona de 90 años de edad con deterioro cognitivo leve tiene un mayor riesgo de progresión a la demencia que una de 70 años de edad, que de otro modo se deteriora de manera similar.
Debido a la variabilidad inherente en el diagnóstico clínico de deterioro cognitivo leve (DCL), algunas personas diagnosticadas con DCL tardío puede parecer cognitivamente normales. Sin embargo, incluso cuando DCL se diagnostique y posteriormente revierta por mejoría en la cognición, los individuos una vez diagnosticados con DCL tienen un mayor riesgo para la futura disminución en comparación con personas que nunca fueron consideradas con DCL.9, 10, 11 En contraste, las personas con demencia casi siempre empeoran con el tiempo.12, 13
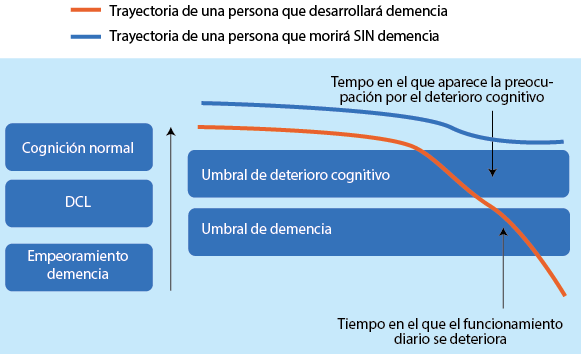
Naturaleza del Deterioro Cognitivo
El funcionamiento cognitivo se caracteriza típicamente en 1 de 5 dominios:
(1) Aprendizaje y memoria
(2) Lenguaje
(3) Visoespacial
(4) Ejecutivo
(5) Psicomotor
Estos dominios tienen una correspondencia aproximada con su localización cerebral. Para un diagnóstico de DCL, sólo una de estas áreas debe verse afectada, mientras que un diagnóstico de demencia requiere que más de un dominio debe verse afectada. La evidencia de la participación de los dominios individuales se puede obtener de la historia clínica, de un breve examen del estado mental, o de pruebas neuropsicológicas.
El olvido es intrínsecamente humano y aumenta con la edad. Es parte de la experiencia normal olvidar alguna vez un nombre o una cita. Podemos colocar mal un reloj o las llaves de vez en cuando. Sin embargo, cuando tales eventos se vuelven frecuentes, la sospecha debe ser alta acerca de que hay más un olvido simplemente normal. Del mismo modo, la frecuente re-formulación de preguntas es mucho más probable que indique un deterioro sustancial de la memoria.14
La primera manifestación más común de deterioro cognitivo patológico en los ancianos es la disminución de la eficiencia de la memoria, a menudo ejemplificada por la re-formulación de preguntas. El reto para los médicos es apreciar donde está el límite entre lo normal y lo anormal para un paciente particular.
En nuestro caso ilustrativo, el paciente estaba repitiéndose a sí mismo en la conversación, y su esposa se había hecho cargo de rellenar sus recetas porque él se olvidaba de hacerlo. Estos síntomas sugieren un trastorno amnésico, en el caso de nuestro paciente, deterioro cognitivo leve amnésico.
Las alteraciones cognitivas no amnésicas son casi tan comunes como las formas amnésicas. El deterioro no amnésico puede implicar dificultades para encontrar palabras y dificultades en el habla, deterioro de la orientación geográfica, problemas de percepción visual y agilidad mental dañada.
Cuando hay una disfunción en más de un dominio cognitivo en personas con deterioro cognitivo leve, denominado DCL multidominio, el riesgo de evolución hacia la demencia es mucho mayor que cuando hay problemas de memoria aisladas o problemas para encontrar palabras.9,15
La pérdida de la consciencia de las propias dificultades cognitivas de uno es común, aunque no invariable, tanto de DCL y la demencia leve. Contrariamente a la tradición clínica, las personas que de otra manera aparecen cognitivamente intactas, pero reportan dificultades cognitivas tienen una probabilidad ligeramente mayor de experimentar declive cognitivo en el futuro.14, 16
Sin embargo, los médicos deben tener cuidado en el uso de las quejas cognitivas subjetivas como factor pronóstico debido a la ganancia secundaria, a los rasgos de depresión, o de la personalidad de toda la vida que también pueden producir quejas cognitivas.
En nuestro caso, la pérdida de la consciencia del problema es la cuestión: fue su esposa y no el paciente quien mencionó las preocupaciones cognitivas al médico. Esto podría sugerir que su enfermedad está algo más avanzada; los pacientes en las primeras etapas de DCL a menudo tienen un poco de preservación de la consciencia de su propio deterioro cognitivo.
Diagnóstico Clínico de deterioro cognitivo leve y de demencia leve
Una historia clínica y un examen del estado mental son las principales herramientas para el diagnóstico de DCL o demencia leve. La historia clínica es el principal medio por el cual el médico determina si el paciente tenga una alteración en el funcionamiento diario.
El examen del estado mental es el medio por el cual el médico establece si existe evidencia objetiva de deterioro cognitivo. Se requiere juicio clínico para integrar la información de las dos fuentes. Un examen neurológico general, también se debe realizar, pero su papel en el proceso de diagnóstico es en gran parte para contribuir a la comprensión de la etiología del trastorno cognitivo.
Una historia clínica detallada, tanto del paciente como de alguien que conozca bien al paciente es esencial. En las primeras etapas de DCL, los pacientes son conscientes de sus dificultades cognitivas y pueden a su vez aumentar la preocupación con su médico. Generalmente, sin embargo, es necesario un informante que conozca bien el paciente para corroborar las propias observaciones del paciente. Encontrar a tal individuo y encontrar el tiempo para entrevistar a un informante es uno de los mayores desafíos para el diagnóstico en el ámbito de la atención primaria.
Están disponibles varios inventarios de actividades de la vida diaria para el uso clínico de rutina, el Funcional Questionnaire de 10 ítems 17, 18 es un instrumento válido para caracterizar el funcionamiento diario. Aunque el cuestionario no se administra textualmente, el contenido de los 10 artículos es una guía útil para la indagar acerca de las fortalezas y debilidades de una persona en la vida cotidiana.
La comprensión de otras condiciones médicas del paciente, si existen, es de gran relevancia para la colocación de los síntomas cognitivos en perspectiva (contexto / comorbilidades). Por ejemplo, un paciente con insuficiencia cardíaca congestiva grave o enfisema pulmonar podría tener hipoxemia, hipercapnia, o hematocrito marcadamente elevado, todo lo cual podría afectar el funcionamiento cognitivo.
Todos los medicamentos que recibe el paciente también deben ser revisados cuando se considera el diagnóstico de deterioro cognitivo. Muchos medicamentos ampliamente utilizados tienen el potencial de afectar la cognición. Los sedantes, narcóticos para el dolor y los medicamentos con perfiles anticolinérgicos son los de mayor preocupación. Además, la ansiedad o la depresión pueden contribuir a las dificultades cognitivas.
[highlight color=»orange» align=»»]Cuestionario de actividades funcionales durante las últimas 4 semanas, ¿el paciente tiene alguna dificultad o necesitan ayuda con:[/highlight]
1. Escribir cheques, pagar las cuentas, o equilibrar una chequera.
2. Montaje de registros de impuestos, asuntos de negocios, u otros documentos.
3. Comprar solo la ropa, artículos del hogar, o comestibles.
4. Jugar un juego de habilidad, trabajar en un hobby.
5. Manejar el agua de calefacción, servirse una taza de café, apagar la estufa.
6. Preparar una comida equilibrada.
7. Hacer un seguimiento de los acontecimientos actuales.
8. Seguir un programa de televisión, un libro o revista y ser capaz de hablar de ellos con los conocidos.
9. Recordar citas o acordarse de tomar los medicamentos, el seguimiento de las conversaciones recientes, eventos recientes, y la fecha.
10. Conducción, viajar fuera del barrio, o hacer arreglos para tomar el transporte público.
[highlight color=»orange» align=»»]Guía de puntuación: 0 = se puede hacer esto sin ayuda o nunca lo hizo la actividad; 1 = tienen alguna dificultad pero puede hacerlo sin ayuda; 2 = necesita ayuda con esto; 3 = no pueden hacer esto.[/highlight]
La segunda herramienta para el diagnóstico del deterioro cognitivo es el examen del estado mental. Hay varios instrumentos diseñados para su uso en entornos de atención primaria, esos exámenes pueden tardar 10 minutos para completarse.
El Montreal Cognitive Assessment 20, 21 y el Short Test of Mental Status 22, 23 son dos instrumentos que utilizamos.
Los instrumentos empleados para los exámenes del estado mental no son herramientas perfectas, pero son mucho más sensibles que las conversaciones casuales o preguntas ad hoc.
En nuestro caso clínico, las anomalías en un examen del estado mental proporcionarían importante confirmación de las observaciones de la esposa. Una puntuación «normal» también sería informativa. Por lo tanto, si el paciente, la familia o el médico sospechan deterioro cognitivo, debe realizarse la remisión para una evaluación neuropsicológica 24.
Una evaluación más detallada de la cognición dependería en parte de los deseos del paciente y de su familia, la experiencia del profesional de la salud, y la accesibilidad a las consultas con un neurólogo, psiquiatra, geriatra, o neuropsicólogo para obtener más experiencia en el diagnóstico. La decisión también depende de la gravedad del deterioro cognitivo y de las consecuencias del diagnóstico. Cuando los síntomas son leves o inciertos o cuando las decisiones importantes de la vida están en juego, las pruebas neuropsicológicas pueden ser invaluables.
Los estudios por imágenes y los análisis de sangre son una parte necesaria de la evaluación ante la sospecha de deterioro cognitivo. Las pruebas de laboratorio no pueden responder a la pregunta de si el paciente tiene deterioro cognitivo, pero pueden ayudar a establecer una etiología del trastorno cognitivo.
La Academia Americana de Neurología recomienda una simple batería de pruebas de laboratorio y un estudio de imágenes cerebrales, como parte de la evaluación inicial de una persona con sospecha de demencia.25
Una resonancia magnética cerebral sin contraste DCL.26 (RM) o tomografía computarizada del cerebro (CT) proporcionarán suficientes pruebas para descartar tumores cerebrales, hematoma subdural, y otras lesiones estructurales del cerebro. La RMN o TAC de rutina también pueden mostrar evidencia de enfermedad cerebrovascular, la RMN es mucho más sensible que la TAC. Estas técnicas de exploración simples, sin embargo, no se pueden utilizar para diagnosticar enfermedad de Alzheimer. Nuestro paciente debe someterse a estudios de laboratorio, tales como la medición de sus niveles de vitamina B12 y de tirotropina y a un estudio de imágenes cerebrales.
Etiología
En personas mayores de 65 años, la enfermedad de Alzheimer es la causa más común de DCL y demencia leve.27 leve, 28, 29 El deterioro amnésico es más típico del Alzheimer ya sea en el DCL o en la demencia en fase leve. Sin embargo, otras enfermedades también pueden causar DCL y demencia leve, y las comorbilidades son encontradas a menudo junto con la enfermedad de Alzheimer.
La enfermedad vascular cerebral que causa infartos cerebrales se vuelve más común con la edad también. Las estimaciones varían ampliamente en cuanto a la contribución exacta de la enfermedad cerebrovascular a DCL y a la demencia leve, pero probablemente es clínicamente importante.29
La RMN cerebral puede revelar infartos silentes o grandes cambios en la materia blanca que se consideran de naturaleza isquémica. Los pacientes con pruebas de imagen de estas lesiones que también tienen factores de riesgo vascular pueden ser tratados de manera diferente que los pacientes sin estos hallazgos en las imágenes. Ambas deficiencias amnésicas y no amnésicas ocurren con la enfermedad cerebrovascular.
La enfermedad de Parkinson con deterioro cognitivo concomitante, que ahora se conoce como enfermedad de cuerpos de Lewy, también se vuelve más común con la edad. En su presentación típica, la enfermedad con cuerpos de Lewy puede causar deterioro cognitivo y parkinsonismo, cambios importantes en la personalidad, y alteraciones en el sueño y la vigilia. Su perfil cognitivo leve es típico es el de un DCL no amnésico.30
La degeneración frontotemporal es la menos común de las demencias degenerativas, pero también puede producir un síndrome de DCL.
La depresión, múltiples comorbilidades médicas, y los efectos adversos de los medicamentos a veces pueden producir deterioro cognitivo; en principio, el pronóstico de estas etiologías es más favorable que para la enfermedad neurodegenerativa.
En general, la enfermedad de Alzheimer y otras enfermedades neurodegenerativas y la enfermedad cerebrovascular son inevitablemente progresivas. Por lo tanto, cuando son la causa de la DCL y de la demencia leve, se puede anticipar deterioro creciente de la función cognitiva.
Tratamiento
El tratamiento de los pacientes con deterioro cognitivo leve y demencia leve debe incluir un fuerte estímulo para permanecer física, social y mentalmente activos. Un estudio de personas con deterioro de la memoria subjetiva mostró claros, aunque modestos, beneficios del ejercicio físico.31
Aunque una revisión de las intervenciones no farmacológicas en DCL o demencia afirmó que las pruebas eran débiles, 32 creemos que la estimulación mental y física debe ser alentada. Asimismo, no hay estudios prospectivos sobre los efectos de un tratamiento más agresivo de los factores de riesgo vascular, 32 pero la gestión de los factores de riesgo vascular es parte de una buena atención general.
El tratamiento farmacológico del DCL presume que es debido a la enfermedad de Alzheimer y el tratamiento del DCL debido a otras enfermedades neurodegenerativas no está disponible.
Se han realizado varios ensayos con inhibidores de la colinesterasa en personas con DCL de tipo amnésico, el tipo más probable que sea debido a la enfermedad de Alzheimer subyacente. Los resultados han sido desalentadores.33, 34 Si bien un indicio de beneficio de tratamiento en forma de retraso de la progresión de la demencia fue documentado en un estudio33 que encontró un efecto positivo de donepecilo durante 12 meses y hasta 24 meses con los transportadores de apolipoproteína ε4, la beneficio no persistió durante 36 meses del estudio.
Tres inhibidores -donepezilo, rivastigmina, galantamina y la colinesterasa- están aprobados para el tratamiento de la demencia leve debido al Alzheimer. El tratamiento de los pacientes con demencia leve debido a enfermedad de Alzheimer tiene beneficios tangibles pero moestos.35, 36
La decisión de tratar a nuestro paciente con un inhibidor de la colinesterasa dependería de los resultados de nuestra evaluación clínica y de las pruebas neuropsicológicas formales, así como de nuestra impresión de la probabilidad de que el Alzheimer fuera la etiología subyacente. No hay tratamientos aprobados por la Administración de Alimentos y Medicamentos de Estados Unidos para el DCL.
Justificación de Diagnóstico
El deterioro cognitivo de nueva aparición es común y es un síntoma preocupante para pacientes y familiares. Si un paciente está teniendo dificultades en la gestión de los medicamentos, las finanzas, el transporte o para vivir de forma independiente, el diagnóstico y la intervención son necesarios para garantizar la salud y la seguridad del paciente.
Reconociendo que carecemos de terapias que bloquean la progresión de la enfermedad de Alzheimer u otras demencias degenerativas, hay razones, no obstante, importantes para hacer un diagnóstico.
En primer lugar, si los miembros de la familia sienten que el paciente presenta dificultades cognitivas, afirmando el diagnóstico a través de una evaluación racional permite luchar a brazo partido con la forma en que los trastornos de la memoria o las dificultades cognitivas interfieren con la vida diaria y lo que se necesita para controlarlo.
En segundo lugar, el diagnóstico de DCL permite a las familias planear para el futuro. Algunos pacientes y sus familias pueden optar por desconocer el riesgo futuro, pero otros podrían desear la mayor cantidad de información posible.
Hay quienes argumentan en contra de hacer un diagnóstico de DCL. Recientes estudios críticos destacan los beneficios y desafíos.37 Los críticos señalan el estigma asociado con el diagnóstico de deterioro cognitivo, las modestas oportunidades de intervención, y la reversión ocasional del DCL a la normalidad cognitiva.
En nuestro caso clínico, las dos primeras críticas son refutadas de manera efectiva por la necesidad de que el paciente y su familia de saber qué está pasando. El tercer punto, el pronóstico variable, se puede transportar al paciente y a su familia a través de la discusión y de la educación. Reconocemos que el cribado cognitivo de los ancianos en la ausencia de una preocupación clínica no ha encontrado claro beneficio.38
Sin embargo, las evaluaciones cognitivas dan sus frutos en el largo plazo. Casi todos los médicos apreciarían la certeza añadida para hacer un diagnóstico cuando existe documentación previa que verifica un verdadero cambio en la condición. La situación de nuestro paciente no debe ser vista como un ejemplo de la detección de deterioro cognitivo; en nuestro caso, el cónyuge consultó al médico en busca de ayuda con el problema.
Tendencias futuras
La investigación sobre la imagen y los biomarcadores del líquido cefalorraquídeo es intensa y acelerada, pero la mayoría de los avances aún no han afectado a la práctica clínica habitual. La introducción de imágenes tomográficas por de emisión de positrones del cerebro de β-amiloide39 ha hecho posible en el marco de la investigación y en la práctica clínica(por un costo muy alto, que no estén cubiertos por el seguro) establecer si una persona está albergando niveles anormales de β-amiloide en el cerebro.
La tomografía por emisión de positrones para la detección de la proteína tau también se está estudiando en la investigación.40 Una combinación de imágenes y estudios del líquido cefalorraquídeo se ha introducido con fines de investigación en los criterios diagnósticos de DCL (y la demencia).41, 42 Hasta ahora, sin embargo, el valor clínico de la caracterización de biomarcadores de pacientes con deterioro cognitivo leve o demencia leve no se ha establecido.
Conclusión
El deterioro cognitivo leve y la demencia leve son problemas comunes en nuestra sociedad que envejece. El diagnóstico adecuado y oportuno puede minimizar la disfunción que acompaña a la pérdida cognitiva.
Referencias
Plassman, B.L., Langa, K.M., Fisher, G.G. et al. Prevalence of dementia in the United States: the Aging, Demographics, and Memory Study. Neuroepidemiology. 2007; 29: 125–132
Petersen, R.C., Roberts, R.O., Knopman, D.S. et al. Prevalence of mild cognitive impairment is higher in men: the Mayo Clinic Study of Aging. Neurology. 2010; 75: 889–897
Knopman, D.S., Petersen, R.C., Rocca, W.A., Larson, E.B., and Ganguli, M. Passive case-finding for Alzheimer’s disease and dementia in two U.S. communities. Alzheimers Dement. 2011; 7: 53–60
Petersen, R.C. Mild cognitive impairment as a diagnostic entity. J Intern Med. 2004; 256: 183–194
Albert, M.S., DeKosky, S.T., Dickson, D. et al. The diagnosis of mild cognitive impairment due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement. 2011; 7: 270–279
McKhann, G.M., Knopman, D.S., Chertkow, H. et al. The diagnosis of dementia due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement. 2011; 7: 263–269
American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders: DSM-5. 5th ed. American Psychiatric Association, Washington, DC; 2013
Petersen, R.C. Clinical practice: mild cognitive impairment. N Engl J Med. 2011; 364: 2227–2234
Roberts, R.O., Knopman, D.S., Mielke, M.M. et al. Higher risk of progression to dementia in mild cognitive impairment cases who revert to normal. Neurology. 2014; 82: 317–325
Koepsell, T.D. and Monsell, S.E. Reversion from mild cognitive impairment to normal or near-normal cognition: risk factors and prognosis. Neurology. 2012; 79: 1591–1598
Lopez, O.L., Becker, J.T., Chang, Y.F. et al. Incidence of mild cognitive impairment in the Pittsburgh Cardiovascular Health Study-Cognition Study. Neurology. 2012; 79: 1599–1606
Galasko, D., Edland, S.D., Morris, J.C., Clark, C., Mohs, R., and Koss, E. The Consortium to Establish a Registry for Alzheimer’s Disease (CERAD), part XI: clinical milestones in patients with Alzheimer’s disease followed over 3 years. Neurology. 1995; 45: 1451–1455
Petersen, R.C., Aisen, P.S., Beckett, L.A. et al. Alzheimer’s Disease Neuroimaging Initiative (ADNI): clinical characterization. Neurology. 2010; 74: 201–209
Amariglio, R.E., Townsend, M.K., Grodstein, F., Sperling, R.A., and Rentz, D.M. Specific subjective memory complaints in older persons may indicate poor cognitive function. J Am Geriatr Soc. 2011; 59: 1612–1617
Manly, J.J., Tang, M.X., Schupf, N., Stern, Y., Vonsattel, J.P., and Mayeux, R. Frequency and course of mild cognitive impairment in a multiethnic community. Ann Neurol. 2008; 63: 494–506
Jessen, F., Wiese, B., Bachmann, C…., and German Study on Aging, Cognition and Dementia in Primary Care Patients Study Group. Prediction of dementia by subjective memory impairment: effects of severity and temporal association with cognitive impairment. Arch Gen Psychiatry. 2010; 67: 414–422
Pfeffer, R.I., Kurosaki, T.T., Harrah, C.H. Jr., Chance, J.M., and Filos, S. Measurement of functional activities in older adults in the community. J Gerontol. 1982; 37: 323–329
Teng, E., Becker, B.W., Woo, E., Knopman, D.S., Cummings, J.L., and Lu, P.H. Utility of the Functional Activities Questionnaire for distinguishing mild cognitive impairment from very mild Alzheimer disease. Alzheimer Dis Assoc Disord. 2010; 24: 348–353
United States Agency for Health Care Policy and Research. Early Identification of Alzheimer’s Disease and Related Dementias. US Dept of Health and Human Services, Public Health Service, Agency for Health Care Policy and Research, Rockville, MD; 1996 (Clinical Practice Guideline 19)
Nasreddine, Z.S., Phillips, N.A., Bédirian, V. et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc. 2005; 53: 695–699
Rossetti, H.C., Lacritz, L.H., Cullum, C.M., and Weiner, M.F. Normative data for the Montreal Cognitive Assessment (MoCA) in a population-based sample. Neurology. 2011; 77: 1272–1275
Tang-Wai, D.F., Knopman, D.S., Geda, Y.E. et al. Comparison of the Short Test of Mental Status and the Mini-Mental State Examination in mild cognitive impairment. Arch Neurol. 2003; 60: 1777–1781
Kokmen, E., Smith, G.E., Petersen, R.C., Tangalos, E., and Ivnik, R.C. The Short Test of Mental Status: correlations with standardized psychometric testing. Arch Neurol. 1991; 48: 725–728
Fields, J.A., Ferman, T.J., Boeve, B.F., and Smith, G.E. Neuropsychological assessment of patients with dementing illness. Nat Rev Neurol. 2011; 7: 677–687
Knopman, D.S., DeKosky, S.T., Cummings, J.L. et al. Practice parameter: diagnosis of dementia (an evidence-based review); report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2001; 56: 1143–1153
Petersen, R.C., Stevens, J.C., Ganguli, M. et al. Practice parameter: early detection of dementia; mild cognitive impairment (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2001; 56: 1133–1142
Jicha, G.A., Parisi, J.E., Dickson, D.W. et al. Neuropathologic outcome of mild cognitive impairment following progression to clinical dementia. Arch Neurol. 2006; 63: 674–681
Schneider, J.A., Arvanitakis, Z., Leurgans, S.E., and Bennett, D.A. The neuropathology of probable Alzheimer disease and mild cognitive impairment. Ann Neurol. 2009; 66: 200–208
Schneider, J.A., Arvanitakis, Z., Bang, W., and Bennett, D.A. Mixed brain pathologies account for most dementia cases in community-dwelling older persons. Neurology. 2007; 69: 2197–2204
Molano, J., Boeve, B., Ferman, T. et al. Mild cognitive impairment associated with limbic and neocortical Lewy body disease: a clinicopathological study. Brain. 2010; 133: 540–556
Lautenschlager, N.T., Cox, K.L., Flicker, L. et al. Effect of physical activity on cognitive function in older adults at risk for Alzheimer disease: a randomized trial. ([published correction appears in JAMA. 2009;301(3):276])JAMA. 2008; 300: 1027–1037
Daviglus, M.L., Plassman, B.L., Pirzada, A. et al. Risk factors and preventive interventions for Alzheimer disease: state of the science. Arch Neurol. 2011; 68: 1185–1190
Petersen, R.C., Thomas, R.G., Grundman, M. et al. Alzheimer’s Disease Cooperative Study Group. Vitamin E and donepezil for the treatment of mild cognitive impairment. N Engl J Med. 2005; 352: 2379–2388
Doody, R.S., Ferris, S.H., Salloway, S. et al. Donepezil treatment of patients with MCI: a 48-week randomized, placebo-controlled trial. Neurology. 2009; 72: 1555–1561
Bond, M., Rogers, G., Peters, J. et al. The effectiveness and cost-effectiveness of donepezil, galantamine, rivastigmine and memantine for the treatment of Alzheimer’s disease (review of Technology Appraisal No. 111): a systematic review and economic model. Health Technol Assess. 2012; 16: 1–470
Raina, P., Santaguida, P., Ismaila, A. et al. Effectiveness of cholinesterase inhibitors and memantine for treating dementia: evidence review for a clinical practice guideline. Ann Intern Med. 2008; 148: 379–397
Petersen, R.C., Caracciolo, B., Brayne, C., Gauthier, S., Jelic, V., and Fratiglioni, L. Mild cognitive impairment: a concept in evolution. J Intern Med. 2014; 275: 214–228
Lin, J.S., O’Connor, E., Rossom, R.C., Perdue, L.A., and Eckstrom, E. Screening for cognitive impairment in older adults: a systematic review for the U.S. Preventive Services Task Force. ([published correction appears in Ann Intern Med. 2014;160(1):72])Ann Intern Med. 2013; 159: 601–612
Clark, C.M., Schneider, J.A., Bedell, B.J…., and AV45-A07 Study Group. Use of florbetapir-PET for imaging β-amyloid pathology. JAMA. 2011; 305: 275–283
Chien, D.T., Bahri, S., Szardenings, A.K. et al. Early clinical PET imaging results with the novel PHF-tau radioligand [F-18]-T807. J Alzheimers Dis. 2013; 34: 457–468
Petersen, R.C., Aisen, P., Boeve, B.F. et al. Mild cognitive impairment due to Alzheimer disease in the community. Ann Neurol. 2013; 74: 199–208
Lowe, V.J., Peller, P.J., Weigand, S.D. et al. Application of the National Institute on Aging-Alzheimer’s Association AD criteria to ADNI. Neurology. 2013; 80: 2130–2137
Atículos de interés más vistos
https://alzheimeruniversal.eu/2021/07/19/el-delirio-erotomaniaco/
Cuidar en el Alzheimer: Consejos Prácticos.
Descubre más desde Alzheimer Universal
Suscríbete y recibe las últimas entradas en tu correo electrónico.
